作者:Jerry
导读:肿瘤干细胞(CSCs)是一类具有高致瘤潜能的细胞亚群,与肿瘤的治疗耐药、转移和复发密切相关。消除CSCs被广泛认为是改善患者预后的关键因素,但有效靶向这些细胞仍然是一个重大挑战。
5月27日,中国科学技术大学研究人员在期刊《Cell Death Discovery》上发表了题为“Inhibition of lysosomal TRPML1 channel eliminates breast cancer stem cells by triggering ferroptosis”的研究论文。本研究中,研究人员证明,溶酶体阳离子通道TRPML1是CSCs的一个有前途的靶点。TRPML1的药理学抑制和基因敲除可促进乳腺CSCs发生铁死亡,降低其干细胞特性,增强乳腺癌细胞对化疗药物阿霉素的敏感性。在小鼠异种移植模型中,TRPML1的抑制和敲除也显示出显著的抗肿瘤形成和生长作用。这些发现表明,将TRPML1作为靶点以消除CSC可能是治疗乳腺癌的一种有效策略。
https://www.nature.com/articles/s41420-024-02026-y#Sec11
01研究背景
乳腺癌是全球范围内最常见的癌症,也是导致女性死亡的主要原因之一,其发病率逐年上升。根据乳腺癌的亚型和分期,患者通常接受手术干预联合辅助治疗,如放疗、化疗、激素治疗和靶向治疗。尽管这些治疗方法可以有效地消除相当比例的癌细胞,但对治疗的耐药性和复发仍然是常见的挑战。近几十年来,新证据表明,被称为癌症干细胞(CSCs)的一小部分癌细胞亚群是这一重大临床挑战的罪魁祸首。CSCs的自我更新、无限增殖和分化潜能维持着癌细胞的活力,而其迁移能力在肿瘤转移中起关键作用。与非干细胞的肿瘤细胞相比,肿瘤干细胞表现出更强的代谢可塑性,使它们能够在糖酵解和氧化磷酸化之间转换,以应对外界的强烈刺激。
02研究进展
为了进一步验证TRPML1在消除CSC方面的重要性,研究人员采用CRISPR-Cas9技术生成了TRPML1敲除HCC1954细胞。设计了一条单向引导RNA(sgRNA)来靶向TRPML1编码基因的第二外显子。随后,研究人员成功获得了两个携带1个或7个碱基缺失的敲除细胞系。通过蛋白质印迹进一步验证了TRPML1的敲除。其中一个敲除细胞系(KO-1)用于后续的体外实验。结果表明,TRPML1缺失会减缓细胞迁移,诱导铁死亡并降低CSC的比例。
为了评估TRPML1抑制对体内肿瘤生长的影响,研究人员使用了乳腺癌异种移植肿瘤小鼠模型。鉴于CSC被认为是肿瘤发生和进展的关键因素,向动物宿主注射CSC可以更容易地诱导肿瘤形成。研究人员将培养的乳腺球体在DMSO或20微摩尔ML-SI1中预孵育3天,然后将分散的乳腺球体细胞移植到裸鼠的乳腺脂肪垫中。ML-SI1治疗组的肿瘤体积和肿瘤重量显著降低。在另一项体内实验中,将HCC1954细胞直接注射到裸鼠的乳腺脂肪垫中,然后每隔一天进行腹腔注射ML-SI1。经过50天后,切除异种移植肿瘤并进行成像。连续给予30毫克/公斤ML-SI1可导致肿瘤体积减小,而不影响小鼠的体重。
此外,研究人员将WT或TRPML1-KO乳腺球细胞或HCC1954细胞注射到裸鼠体内,每两周监测一次肿瘤生长情况。与注射KO细胞的小鼠相比,WT组小鼠的肿瘤生长速度明显加快。因此,KO组小鼠的肿瘤重量显著降低。这些结果共同表明,通过药物抑制和基因敲除两种方式均可有效抑制肿瘤的发生和生长。
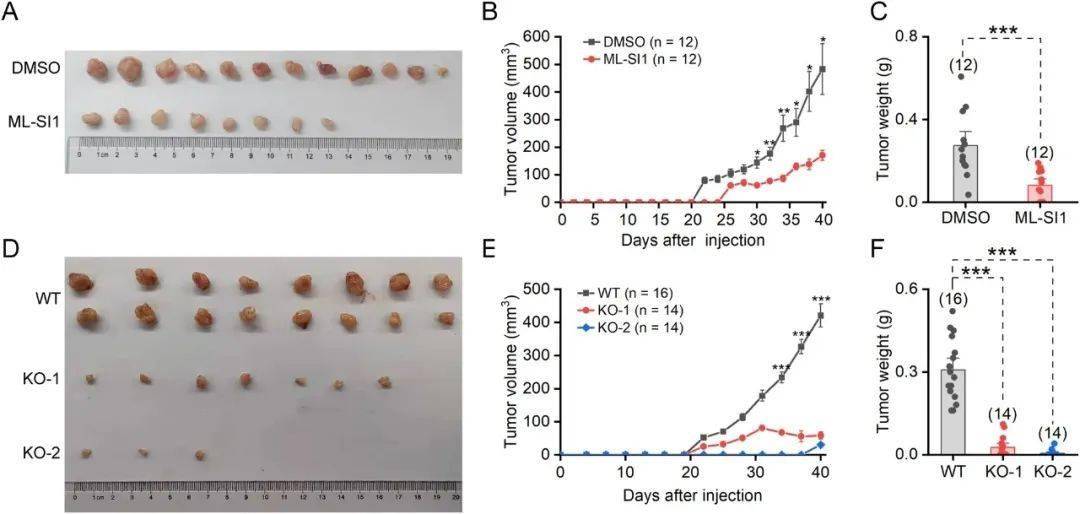
ML-SI1和TRPML1-KO对乳腺肿瘤异种移植瘤生长的影响
03研究结论
总之,本研究结果表明,靶向抑制TRPML1对于消除CSCs具有有效性,从而为癌症治疗提供了一种新的途径。进一步研究TRPML1在肿瘤或CSCs中的特定干扰,同时开发高效、特异性的TRPML1抑制剂,对于推进基于TRPML1的癌症治疗策略具有巨大潜力。
参考资料:
https://www.nature.com/articles/s41420-024-02026-y#Sec11
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
- 本文固定链接: https://x86android.com/articles/27043.html
- 转载请注明: zhiyongz 于 安卓X86中文站 发表

《本文》有 0 条评论